近日,我校生物工程學院細胞功能調控與化學干預科研團隊在國際頂級學術期刊ACS NANO(IF=14.588)上發表了題為“Polyethyleneimine-Modified Mesoporous Silica Nanoparticles Induce a Survival Mechanism in Vascular Endothelial Cells via Microvesicle-Mediated Autophagosome Release”(DOI: org/10.1021/acsnano.1c03456)的研究論文。該團隊張璐教授、2019級碩士研究生馮高青和楊碩曄副教授為共同第一作者,張璐為通訊作者。
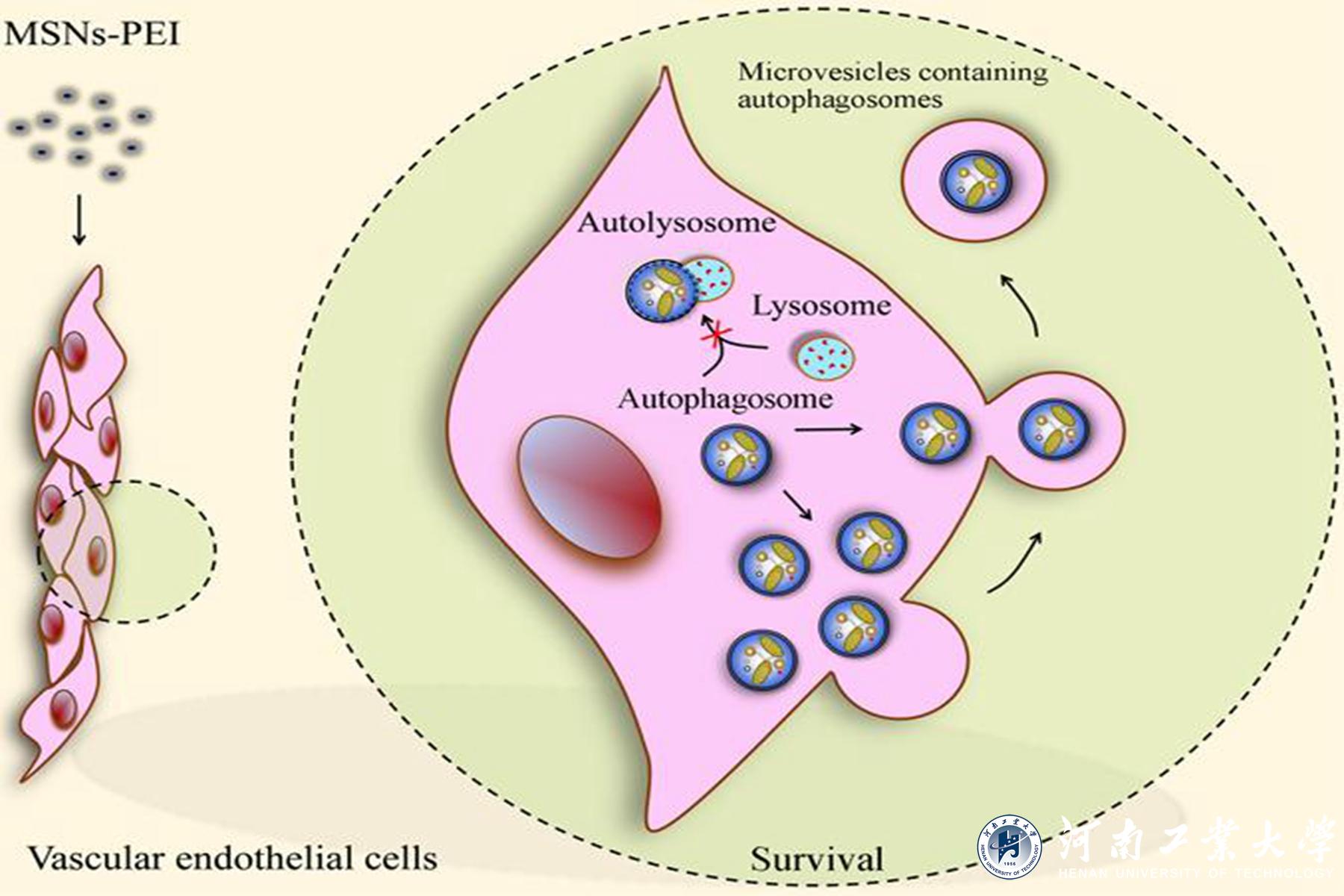
介孔二氧化硅納米顆粒(MSN)近年來被廣泛應用于藥物傳遞、基因載體、診斷和生物成像等領域。與其他納米載體相比,MSN具有良好的生物相容性、高載藥量、無早釋、特異性靶向給藥和活性成分的控制釋放等優點,使MSNs成為最有前途的藥物載體。由于血管內皮細胞是血液和組織交換的“第一屏障”,進入循環的MSNs會直接與血管內皮細胞接觸,評估MSNs對血管內皮細胞的影響對于納米顆粒的安全應用意義重大。
與未修飾的MSNs、氨基修飾的MSNs或脂質體包裹的MSNs不同,100 μg/ml聚乙烯亞胺修飾的MSNs(MSNs-PEI)對人臍靜脈內皮細胞無明顯毒性。然而,MSNs-PEI阻斷自噬小體與溶酶體的融合,誘導自噬小體積聚,這是許多納米顆粒毒性的核心機制。據此,研究者預測在血管內皮細胞中存在一種自噬小體清除的替代途徑來減輕MSNs-PEI誘導的自噬應激。進一步研究發現,MSNs-PEI誘導細胞骨架結構改變,但不引起內質網應激,當MSNs-PEI阻斷自噬小體降解時,積累的自噬小體通過微泡釋放到細胞外空間。阻斷自噬小體的形成或釋放會導致受損線粒體堆積和活性氧的過量產生,進而導致血管內皮細胞死亡。該研究在國際上首次證實當納米顆粒阻斷了自噬小體降解時,細胞產生一種緩解自噬壓力的補償機制,即通過微體介導自噬小體釋放到胞外,維持血管內皮細胞穩態。因此,促進積累自噬小體的釋放可能是對抗納米顆粒血管毒性的一種新的保護策略。
生物工程學院高度注重科研團隊建設,大力支持教師科研工作,細胞生物學研究小組已先后獲得8項國家自然基金項目支持,已先后在細胞自噬方向國際頂級期刊Autophagy(IF=11.059)等發表10余篇高水平論文。該工作得到國家自然科學基金(32070742和31471296)、河南省科技攻關計劃(192102310148)等項目的資助。
